HPLC-PDA法测定明日叶不同部位中的4-羟基德里辛和黄色当归醇含量
作者单位:
- 上海海洋大学食品学院,上海
- 上海市园林科学研究所,上海
- 宜宾学院化学与化工学院,四川 宜宾
- 上海交通大学农业与生物学院,上海
摘 要
采用高效液相色谱配备光电二极管阵列检测器法测定明日叶根、茎和叶中4 – 羟基德里辛(4-hydroxyderricin,4-HD)和黄色当归醇(xanthoangelol,XAG)的含量。样品分析选用Halo C18色谱柱(4.6 mm×150 mm,2.7 μm),流动相为0.1%甲酸(A)-甲醇(B)溶液,梯度洗脱,流速为0.3 mL/min,检测波长为370 nm,柱温为40 ℃。4-HD、XAG在0.945~18.900、1.048~20.960 μg/mL质量浓度范围内线性关系良好,样品含量的相对标准偏差分别为3.13%、2.52%,方法的重复性好,平均回收率分别为103.70%、103.05%。
*AD:关于明日叶,免费咨询更多,添加微信:156440577
经检测明日叶中4-HD的分布规律为:茎(149.16 μg/g)>根(122.42 μg/g)>叶(1.24 μg/g);XAG的分布规律为:根(144.28 μg/g)>茎(75.17 μg/g)>叶(1.21 μg/g)。4-HD和XAG在根和茎中的分布显著高于其在叶中的分布。
关键词:明日叶;4-羟基德里辛;黄色当归醇;高效液相色谱配备光电二极管阵列检测器
英文摘要(Abstract)
Determination of 4-Hydroxyderricin and Xanthoangelol in Different Parts of Angelica keiskei by HPLC-PDA
(College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China;Shanghai Institute of Landscape Gardening Science, Shanghai 200232, China;College of Chemistry and Chemical Engineering, Yibin University, Yibin 644000, China;School of Agriculture and Biology, Shanghai Jiaotong University, Shanghai 200240, China)
Abstract: In this study, the contents of 4-hydroxyderricin (4-HD) and xanthoangelol (XAG) in roots, stems and leaves of Angelica keiskei were determined using high performance liquid chromatography with photo-diode array (HPLC-PDA) detector. The samples were separated on a Halo C18-column (4.6 mm × 150 mm, 2.7 μm), gradiently eluted with 0.1% formic acid in water (A) and methanol (B) at a flow rate of 0.3 mL/min and detected at 370 nm. The column temperature was set at 40 ℃. Good linear relationships between peak area and injection amount of 4-HD and XAG were established within the range of 0.945–18.900 and 1.048–20.960 μg/mL, respectively. The relative standard deviations (RSDs) of peak area for the two compounds were 3.13% and 2.52%, respectively, suggesting good reproducibility of the developed method. The average recoveries of the spiked compounds were 103.70%, and 103.05%, respectively.
The results showed that the distribution of 4-HD in different parts of Angelica keiskei was ranked in decreasing order as follows: stems (149.16 μg/g) > roots (122.42 μg/g) > leaves (1.24 μg/g), while the order of XAG content was as follows: roots (144.28 μg/g) > stems (75.17 μg/g) > leaves (1.21 μg/g). The contents of 4-HD and XAG in roots and stems of Angelica keiskei were significantly higher than in leaves.
*AD:免费领取明日叶30粒、茶包体验装,添加微信:156440577
Key words: Angelica keiskei; 4-hydroxyderricin (4-HD); xanthoangelol (XAG); high performance liquid chromatography
with photo-diode array (HPLC-PDA)
明日叶(Angelica keiskei)是原产于日本伊豆、八丈岛的一种药食兼用的蔬菜,属水芹科多年生草本植物,因今日采摘明日即可发芽而得名[1-3]。
20世纪90年代从日本引进我国,现在逐步发展扩大。明日叶中含有20多种具有生理活性的查尔酮、香豆素类、黄酮类物质,其中4-羟基德里辛(4-hydroxyderricin,4-HD)和黄色当归醇(xanthoangelol,XAG)是明日叶中以苷元形式存在的重要的查尔酮类物质[4-5],具有特殊的抗氧化、抗肿瘤、抗糖尿病、抗血栓等多种生物活性和药用价值,在植物中非常罕见,其化学结构式如图1所示[6-8]。
植物中不同次生代谢产物的分布和积累是有差异的,了解植物体内有效成分含量的分布对药用植物的栽培、采收及开发可以提供指导[9]。然而目前关于明日叶中活性成分4-HD和XAG在明日叶中不同部位(根、茎和叶)的含量差异分析鲜见报道。
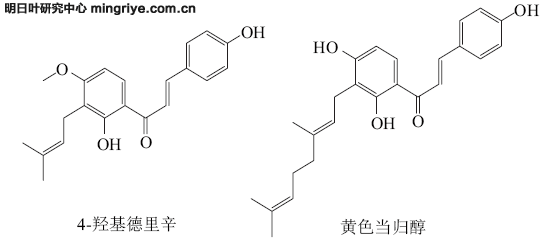
图 1 4-羟基德里辛和黄色当归醇的化学结构式
Fig.1 Chemical structures of 4-hydroxyderricin and xanthoangelol
本实验采用高效液相色谱配备光电二极管阵列(high performance liquid chromatography with photo-diode array,HPLC-PDA)法测定明日叶根、茎、叶3 个部位中4-HD和XAG的含量,为明日叶的开发和利用提供数据基础[10-11]。
*AD:选购明日叶种子、种苗等,基地直发,添加微信:156440577
1 材料与方法
1.1 材料与试剂
明日叶,采自上海交通大学七宝校区明日叶种植基地,采集时间为2014年11月。样品分装后在-20 ℃条件下保存。
4-HD和XAG标准品(纯度均大于98%) 中国科学院上海药物研究所天然产物化学研究室;甲醇(色谱纯) 国药集团化学试剂有限公司;其他溶剂均为国产分析纯。
1.2 仪器与设备
HPLC仪(PDA检测器及Chromquest色谱工作检测站) 美国Thermo Fisher Surveyor公司;Scout-SE型电子天平 奥豪斯仪器常州有限公司;DHG-9140A型电热恒温鼓风干燥箱 上海精宏实验设备有限公司;BCD-189JB-S型冰箱 上海夏普电器有限公司;KQ5200DE型数控超声波清洗器 昆山市超声仪器有限公司;HH-S型数显恒温水浴锅 金坛市岸头国瑞实验仪器厂;TGL-16M高速台式离心机 上海卢湘仪器有限公司;FD-1A-50型冷冻干燥机 北京博医康实验仪器有限公司;HK-02A型100 g手提式粉粹机 广州旭朗机械设备有限公司;RE-52C型旋转蒸发器水浴槽 上海青浦沪西仪器厂;DC-2006型低温恒温槽 上海比朗仪器厂。
1.3 方法
1.3.1 对照品溶液制备
准确称取4-HD、XAG各0.945、1.048 mg,分别置于5 mL容量瓶,加甲醇至刻度,超声溶解得对照品储备液。各吸取1 mL对照品储备液,配成混合对照品储备液。分别准确吸取混合对照品储备液200、150、100、50、10 μL置于1 mL容量瓶中,加甲醇定容,摇匀,配制成一系列混合对照品工作溶液[12]。
1.3.2 供试品溶液制备
明日叶清洗干净,剪切分为叶子、茎干、树根3 个部分,置于-4 ℃条件下冷冻24 h,然后真空冷冻干燥22 h,粉碎,过100 目筛[13-14],得到干燥粉末。按1∶10(g/mL)将样品粉末与体积分数50%乙醇溶液混合,37 ℃水浴加热浸取3 h,冷却到室温,收集乙醇浸取液,按上述方法再浸取样品一次,合并的乙醇浸取液减压回收,至无醇味得到流浸膏。加入8 倍流浸膏质量的去离子水,乙酸乙酯萃取水溶液中目标物质,直至乙酸乙酯萃取液近于无色。合并乙酸乙酯溶液于圆底烧瓶中,在31 ℃、0.1 MPa条件下进行旋转蒸发去除乙酸乙酯,即得样品粗品,保存备用[15-18]。
用甲醇将适量的样品粗品定容至1 mL,超声混匀,过0.45 μm滤膜,备用。
1.3.3 色谱条件
Halo C18色谱柱(4.6 mm×150 mm,2.7 μm);流动相:0.1%甲酸溶液(A)-甲醇(B),梯度洗脱程序如下:0~2 min,30% A;2~40 min,30~0% A;40~45 min,0% A;45.0~45.1 min,0~30% A;45.1~50.0 min,30% A。流速0.3 mL/min;柱温40 ℃;检测波长370 nm;进样量5 μL;检测时间50 min。
1.3.4 HPLC-PDA方法学考察
1.3.4.1 精密度实验
精密吸取混合对照品工作溶液(C4-HD=9.45 μg/mL、CXAG=10.48 μg/mL)5 μL,重复进样5 次,分别得到5 个峰面积,进行精密度实验测定。
1.3.4.2 重复性实验
取样品6 份,照1.3.2节方法平行制备,分别进样测定,计算重复性。
1.3.4.3 加样回收率实验
精密称取已知含量的样品适量共5 份, 分别加入混合对照品储备液(C4-HD=94.5 μg/mL、CXAG=104.8 μg/mL)100 μL,按供试品溶液的测定方法处理,测定峰面积,分别计算加样回收率。
1.3.5 样品含量测定
根据4-HD和XAG的HPLC色谱峰面积,依据下式分别可以算出样品中4-HD和XAG的含量。

式中:A为4-HD或XAG的含量/(μg/g);C样为根据标准曲线得出的被测样品中4-HD或XAG的质量浓度/(μg/mL);V定为样品最终定容体积/mL;M为试样质量/g;F为稀释倍数。
2 结果与分析
2.1 检测波长的选择
对4-HD和XAG的混合对照品储备液在HPLC-PDA中进行分离并且扫描,在波长370 nm处有最大吸收显示,故本实验以370 nm作为扫描波长。
2.2 样品溶剂的选择
提取溶剂一般有甲醇、乙醇、正己烷等,但是甲醇、正己烷等对人体有害。乙醇可有效降低查尔酮酶的活性[19-21],故选择体积分数50%乙醇溶液作为第1步的萃取剂。根据水沉原理,利用体积分数50%乙醇溶液,可减少提取液中淀粉、蛋白质、黏质等成分的浸入,回收
乙醇后,加水静置处理,可除去溶液中的树脂、脂溶性色素,除去杂质及沉淀[22]。目标物的极性较小,根据相似相容原理,故用乙酸乙酯从溶液中萃取目标物[23]。
2.3 HPLC-PDA方法学考察结果
按照1.3.4节实验方法测定,分别可得4-HD峰面积的相对标准偏差(relative standard deviation,RSD)为0.85%,XAG峰面积的RSD为0.93%,表明该方法精密度良好;4-HD含量的RSD为3.13%,XAG含量的RSD为2.52%,表明重复性良好;4-HD的平均回收率为103.70%,XAG的平均回收率为103.05%,RSD均小于2%。说明本实验中的HPLC-PDA方法完全适用于样品的测定。
2.4 线性关系分析
将1.3.1节制备的一系列混合对照品工作溶液,在1.3.3节所述色谱条件下进行峰面积测定,以质量浓度C(μg/mL)为横坐标(X),峰面积S为纵坐标(Y)进行线性回归分析,绘制标准品的标准曲线。4-HD的回归方程为Y=305 439X+1 417 954,R2=0.999 2;XAG的回归方程为Y=288 515X+1 492 839,R2=0.999 3。
结果表明4-HD、XAG在0.945~18.900、1.048~20.960 μg/mL质量浓度范围内线性关系良好。混合对照品工作溶液(C4-HD=9.450 μg/mL、CXAG=10.480 μg/mL)色谱图见图2,4-HD和XAG 2 个峰之间的分离度为1.8,表明本实验的色谱条件完全适用于4-HD和XAG的分离和检测,且分离效果良好。
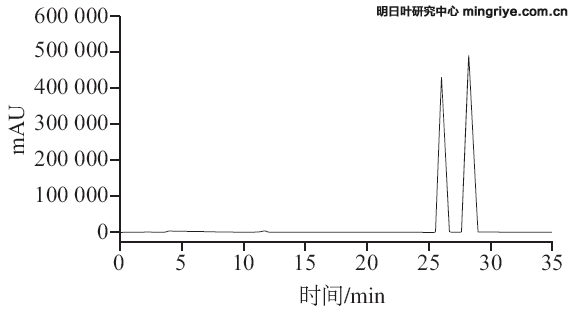
图 2 混合对照品工作溶液HPLC色谱图
Fig.2 HPLC chromatogram of standard mixture
图 2 混合对照品工作溶液HPLC色谱图
Fig.2 HPLC chromatogram of standard mixture
2.5 样品中4-HD和XAG的含量测定
按1.3.3节所述色谱条件进行供试品溶液的测定,在波长370 nm处记录明日根、茎、叶的HPLC图,见图3。
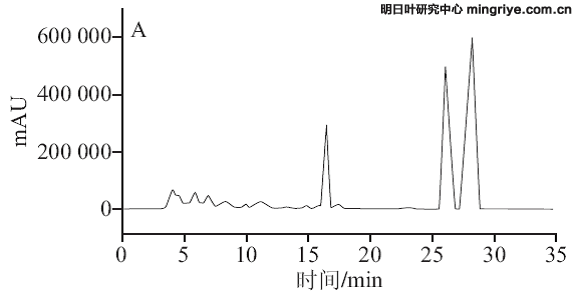
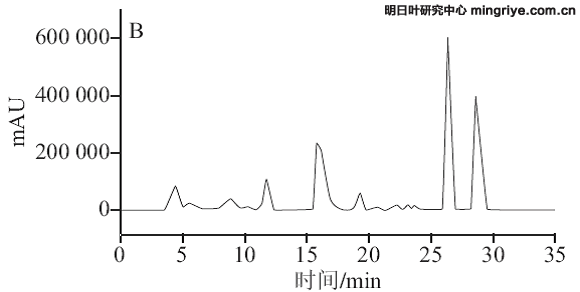
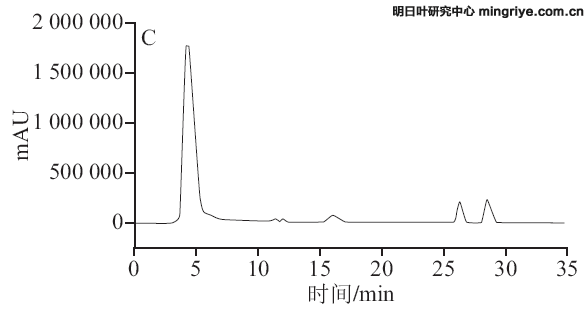
(A.明日叶根提取物;B.明日叶茎提取物;C.明日叶叶提取物)
图 3 明日叶样品HPLC色谱图
Fig.3 HPLC chromatograms of Angelica keiskei extracts
计算样品中4-HD和XAG含量,并对含量进行对比分析,明日叶不同部位中4-HD和XAG的含量测定结果见表1。
| 表 1 明日叶不同部位中4-HD和XAG的含量
Table 1 Contents of 4-HD and XAG in different parts of Angelica keiskei |
||
| 部位 | 4-HD含量/(μg/g) | XAG含量/(μg/g) |
| 叶 | 1.24±0.04 | 1.21±0.03 |
| 茎 | 149.16±3.94 | 75.17±2.12 |
| 根 | 122.42±3.84 | 144.28±3.56 |
2.6 不同部位4-HD和XAG含量比较
明日叶各部位均含有4-HD和XAG,且各部位之间差异较大,4-HD主要分布在茎中。明日叶各部位4-HD的含量依次为:茎(149.16 μg/g)>根(122.42 μg/g)>叶(1.24 μg/g)。根、茎与叶这3 个部位之间4-HD的含量差异显著。茎中4-HD的含量最高,是根、叶含量的1.2~120.3 倍。
明日叶中X A G 含量的分布规律依次为: 根(144.28 μg/g)>茎(75.17 μg/g)>叶(1.21 μg/g),和4-HD的分布特点有所不同。根、茎、叶这3 个部位之间含量差异更明显,尤其根中XAG含量最高,是茎、叶的1.9~119.2 倍。
这3 个部位中,根和茎干中的4-HD和XAG的含量显著大于叶中的含量,茎干中4-HD(149.16 μg/g)的含量与根中(122.42 μg/g)的含量差值为26.74 μg/g,远小于明日叶根中XAG(144.28 μg/g)的含量与茎干(75.17 μg/g)的差值69.11 μg/g。且明日叶根中4-HD和XAG的含量都比较高,故从经济实际角度考虑,明日叶根比茎干在提取、利用4-HD和XAG方面更具有利用价值。
3 结 论
本实验在流动相为体积分数0.1%甲酸溶液和甲醇溶液,梯度洗脱、流速为0.3 mL/min、检测波长为370 nm、柱温为40 ℃的HPLC条件下,考察了明日叶植株不同部位(根、茎和叶)中4-HD和XAG含量分布情况。4-HD和XAG在明日叶的根部和茎部分含量较高,而其在叶片部分含量很低。
4-HD在茎部的含量大于根部,但两者之间的差异性不大,XAG在根部的含量明显大于其茎部,相比而言,根中4-HD和XAG这2 种物质含量都较高,更有实际利用价值。这表明明日叶植株不同部位的4-HD和XAG的代谢累积不均匀,具有部位选择性。该研究将对明日叶的不同部位合理开发利用提供理论依据。
参考文献
[1] 陈思婷, 覃伟权, 冯美利, 等. 绿色保健蔬菜长寿芹[J]. 中国热带农业, 2007(1): 43. DOI:10.3969/j.issn.1673-0658.2007.01.023.
[2] 韩曙, 张云逸, 张宏, 等. 珍稀蔬菜: 明日叶[J]. 长江蔬菜, 2002(2): 11.
[3] 韩嘉义. 长寿菜-明日叶[J]. 植物杂志, 2001(4): 16.
[4] 周先丽, 梁成钦, 徐庆, 等. 明日叶的化学成分[ J ] . 中国实验方剂学杂志, 2 0 1 2 , 1 8 ( 3 ) : 1 0 3 – 1 0 5 . D O I : 1 0 . 3 9 6 9 /j.issn.1005-9903.2012.03.032.
[5] TOSHIYUKI N, TAKAHIRO T, KYUICHI K, et al. Absorption and metabolism of 4-hydroxyderricin and xanthoangelol after oral administration of Angelica keiskei (Ashitaba) extract in mice[J]. Archives of Biochemistry and Biophysics, 2012, 521(1/2): 71-76. DOI:10.1016/j.abb.2012.03.013.
[6] 侯芳霖, 钟进义, 张燕. 明日叶查尔酮对荷瘤小鼠抗氧化能力影响作用的研究[J]. 世界中西医结合杂志, 2011, 6(4): 288-290. DOI:10.3969/j.issn.1673-6613.2011.04.005.
[7] TOSHIHIRO A, HARUKUNI T, MOTOHIKO U, et al. Chalcones, coumarins, and flavanones from the exudate of Angelica keiskei and their chemopreventive effects[J]. Cancer Letters, 2003, 201(2): 133-137. DOI:10.1016/S0304-3835(03)00466-X.
[8] 刘畅, 王正武, 吴金鸿. 药食兼用植物明日叶的研究进展及应用[J].食品与药品, 2013, 15(3): 205-209. DOI:10.3969/j.issn.1672-979X.2013.03.022.
[9] 杨玲娟, 焦成瑾, 高二全. 三七中三七素及其异构体的高效液相色谱检测[J]. 中药材, 2015, 38(2): 311-314. DOI:10.13863/j.issn1001-4454.2015.02.026.
[10] DAEWOOK K, MARCUS J, CURTIS L. Quantitative analysis of phenolic metabolites from different parts of Angelica keiskei by HPLC-ESI MS/MS and their xanthine oxidase inhibition[J]. Food Chemistry, 2014, 153: 20-27. DOI:10.1016/j.foodchem.2013.12.026.
[11] 侯璐, 钱和. 高效液相色谱法测定刺梨中维生素C的含量[ J ] .食品工业科技, 2 0 0 9 , 3 0 ( 8 ) : 3 1 1 – 3 1 3 . D O I : 1 0 . 1 3 3 8 6 /j.issn1002-0306.2009.08.077.
[12] KYUICHI K, KEISUKE S, KAZUNORI L, et al. Prenylated chalcones 4-hydroxyderricin and xanthoangelol stimulate glucose uptake in skeletal muscle cells by inducing GLUT4 translocation[J]. Molecular Nutrition and Food Research, 2011, 55(3): 467-475. DOI:10.1002/mnfr.201000267.
[13] MATSUURA M, KIMURA Y, NAKATA K. Artery relaxation by chalcones isolated from the roots of Angelica keiskei[J]. Planta Medice, 2001, 67(3): 230-235. DOI:10.1055/s-2001-12011.
[14] 郭晓青, 吴金鸿, 刘畅, 等. 明日叶的茎与叶主要抗氧化成分含量及抗氧化性比较[J]. 食品与发酵工业, 2013, 39(8): 122-127.DOI:10.13995/j.cnki.11-1802/ts.2013.08.003.
[15] 李法庆, 刘东峰. 一种从明日叶中提取4-羟基德里辛的方法: 中国, 2011102186938[P/OL]. [2013-02-06]. https://epub.sipo.gov.cn/patentoutline.action.
[16] 中山策敏, 滕秀兰. 一种明日叶中查尔酮类成分的提取工艺: 中国, 2010102991890[P/OL]. [2011-04-20]. https://epub.sipo.gov.cn/patentoutline.action.
[17] KIMURA Y, TANIGUCHI M, BABA K. Antitumor and antimetastatic activities of 4-hydroxyderricin isolated from Angelica keiskei roots[J]. Planta Medica, 2004, 70(3): 211-219. DOI:10.1055/s-2004-815537.
[18] YOSHIYUKI K, KIMIYE B. Antitumor and antimetastatic activities of Angelica keiskei roots, part 1: isolation of an active substance, xanthoangelol[J]. International Journal of Cancer, 2003, 106(3): 429-437. DOI:10.1002/ijc.11256.
[19] 宁鸿珍, 陈欣华, 王曼曼, 等. 超声波辅助提取明日叶查尔酮的工艺优化[J]. 食品研究与开发, 2014, 35(8): 34-37. DOI:10.3969/j.issn.1005-6521.2014.08.1.
[20] 尹慧丹, 田大永, 方波. 微波辅助提取明月草叶查尔酮工艺研究[J].食品工业, 2011, 32(11): 43-46.
[21] 徐怀德. 天然产物提取工艺学[M]. 北京: 中国轻工业出版社, 2011: 348.
[22] TOSHIHIRO A, HARUKUNI T, DAISUKE H, et al. Chalcones and other compounds from the exudates of Angelica keiskei and their cancer chemopreventive effects[J]. Journal of Natural Products, 2006, 69(1): 38-42. DOI:10.1021/np058080d.
[23] LEI L, GIANCARLO A, MARINA C, et al. Characterisation, extraction efficiency, stability and antioxidant activity of phytonutrients in Angelica keiskei[J]. Food Chemistry, 2009, 115(1):227-232. DOI:10.1016/j.foodchem.2008.12.015.
*AD:购买明日叶茶、明日叶粉,十年品牌,品质护航,添加微信:156440577








