明日叶保健茶的毒性及致突变和致畸性(结论无毒)
研究地点:成都市卫生防疫站,四川成都,610021
摘 要
目的:
*AD:关于明日叶,免费咨询更多,添加微信:156440577
评估明日叶保健茶的毒性及致突变性和致畸性。
方法:
采用急性毒性试验、Ames试验、微核试验、小鼠精子畸形试验、骨髓细胞染色体畸变试验、30d喂养试验和传统致畸试验等。
结果:
急性毒性试验为实际无毒级;致突变试验为阴性;在30d喂养试验中,未见引起大鼠的整体健康状况、生理生化功能和器官组织形态学各重要指标的异常变化;在传统致畸试验中未见发育毒性。
结论:
“明日叶保健茶”在推荐剂量[3g/(d•人)]下,食用是安全的。
*AD:免费领取明日叶30粒、茶包体验装,添加微信:156440577
关键词:明日叶;致突变性;致畸性
“明日叶”学名叫AngelicaKeiskeiKoidzumi。原产地在日本八丈岛,岛民多食用明日叶,均很长寿,因此又名长寿草。明日叶具有提高机体免疫力、润肠通便、改善睡眠、延缓衰老等多重功效,具有广泛的开发和应用价值。因此,某研究所开展了长寿草的引种工作,并开发出保健茶等。为确保食用人群的健康,本文按《食品安全性毒理学评价程序和方法》[1]的相关要求,对“明日叶保健茶”的毒性进行了系统的研究。
1 材料与方法
1.1 受试物
明日叶保健茶由四川佳寿康复工程研究所提供,样品呈绿色粉状,试验时用蒸馏水配制成所需浓度的混悬液。
1.2 试验动物
*AD:选购明日叶种子、种苗等,基地直发,添加微信:156440577
昆明种小鼠,SD大鼠由四川省抗菌素工业研究所提供。整个实验,动物自由摄食和饮水,室温20~25℃,相对温度60~75%。
1.3 急性毒性试验
均按霍恩氏(Horn)法设计剂量。
1.3.1 小鼠急性毒性试验
选用昆明种小鼠,设1000、2150、4640和10000mg/(kg•bw)4个剂量组。
1.3.2 大鼠急性毒性试验
选用SD大鼠,设2150、4640、10000和21500mg/(kg•bw)4个剂量组。
1.4 遗传毒性试验
1.4.1 Ames试验 菌株为TA97、TA98、TA100和TA102,由四川省卫生防疫站提供,鉴定符合要求后进行试验。Sg、2-AF及MMC等均由华西医科大学提供,所有试剂皆为分析纯。
1.4.2 骨髓微核试验
选用昆明种小鼠,雌雄分开,设625、1250和2500mg/(kg•bw)3个剂量组。另设阴性对照组(0.85%NaCl)和阳性对照组环磷酰胺(30mg/(kg•bw)CP)。
1.4.3 小鼠精子畸形试验
设625、1250和2500mg/(kg•bw)3个剂量组,另设0.85%NaCl和环磷酰胺分别作阴性对照和阳性对照组。
1.4.4 骨髓细胞染色体畸变试验
选用昆明种小鼠,设500、1000和2000mg/(kg•bw)3个剂量组,另设0.85%NaCl(阴性对照)和阳性对照组(30mg/(kg•bw)CP)。
1.5 30天喂养试验
选用SD大鼠,体重130~160g,将动物随机分为4组。设300、1200和5000mg/(kg•bw)3个剂量组(分别相当于成人推荐剂量3g/d•人的6、24和100倍)以及蒸馏水对照组。
1.6 传统致畸试验
健康成熟的未交配SD大鼠,夜间按雄雌1∶2合笼,次日检查是否交配。将查出的“孕鼠”随机分为4组。设300、1200和5000mg/(kg•bw)3个剂量组和蒸馏水阴性对照组。
2 结果
2.1 急性毒性试验
2.1.1 小鼠急性毒性试验
按前述方法进行实验,观察期14d内,雌鼠、雄鼠均无死亡,其对雌雄鼠的LD50均大于10000mg/kg体重。
2.1.2 大鼠急性毒性试验
按前述方法进行实验,观察期14d内,雌、雄鼠动物死亡情况为0、0、3和5只,死亡时间为2~5d,尸解胃内充满受试物,未见其它脏器异常。查表得LD50为9260mg/(kg•bw),95%可信区间为6360~13500mg/(kg•bw)。按急性毒性(LD50)分级标准属实际无毒级。
2.2 遗传毒性试验
2.2.1 Ames试验
由表1可知,各剂量组在加与不加Sg的条件下每皿回变菌落数均未超过对照组的两倍,也不存在剂量关系。故按Ames试验评价标准,明日叶保健茶Ames试验结果为阴性。
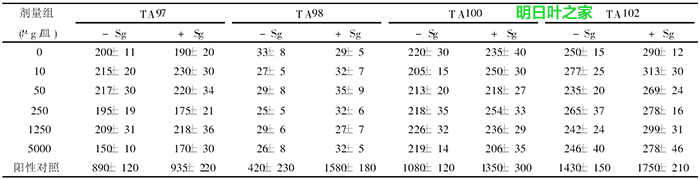
表1 明日叶保健茶Ames试验结果( x-± s)
* 阳性物: – Sg、TA97、T A98、T A100为4-硝基喹啉氧( 0. 5μg /皿) , TA102为M MC ( 0. 5μg /皿) , + Sg、TA97、TA98、T A100均为2-AF ( 10μg /皿) , TA102为顺铂( 20μg /皿)。
2.2.2 小鼠骨髓嗜多染红细胞微核试验
在所设剂量2500、1250和625mg/(kg•bw)范围内,雄鼠PCE微核率为2.80‰、2.80‰、2.40‰与阴性对照(2.20‰)比较(i2检验),差异无显著性(P>0.05)。雌性PCE微核率为3.00‰、2.20‰和2.60‰,与阴性对照(2.40‰)比较(i2检验),差异无显著性(P>0.05)。微核试验结果为阴性。
2.2.3 小鼠精子畸形试验
在所设剂量625、1250和2500mg/(kg•bw)范围内,所得精子畸形率分别为2.35%、2.90%和2.70%与阴性对照(2.65%)比较(i2),差异无显著性(P>0.05)。
2.2.4 小鼠骨髓细胞染色体畸变试验
在所设剂量625、1250和2500mg/(kg•bw)范围内,雄性组的骨髓细胞染色体畸变发生率为3.40%、4.00%和3.80%与阴性组(3.60%)比较(i2),差异无显著性(P>0.05)。雌性组为3.20%、3.60%和3.80%与阴性组(3.80%)比较(i2),差异无显著性(P>0.05)。
2.3 30d喂养试验
2.3.1 动物生长状况及血液学指标的检测
溶剂对照组与3个剂量组动物在30d染毒期间,摄食、饮水、大小便正常,平均增重和平均食物利用率差异无显著性。对照组和300、1200、5000mg/(kg•bw)3个剂量组平均血红蛋白含量(g/L)分别为128.0、129.5、129.2、127.4;白细胞计数(×109/L)分别为11.2、12.1、12.5、11.8;红细胞计数分别为(×1012/L)6.2、6.1、6.2、6.0。经统计学处理(t检验),各组动物血红蛋白含量,白细胞计数及红细胞计数差异无显著性(P>0.05)。
2.3.2 生物化学指标的影响
喂养结束后,各组动物的谷丙转氨酶(ALT)、谷草转氨酶(AST)、白蛋白/球蛋白比(A/G)及甘油三酯(TG)、总蛋白(TP)、总胆固醇(TC)、血浆葡萄糖(GLU)等指标中,仅高剂量组的总蛋白(TP)与溶剂对照组比较有显著增加(F检验,P<0.01),肝TP合成量增加是有益的生物反应,其它各项指标与阴性对照组比较差异无显著性(P>05)。见表2。
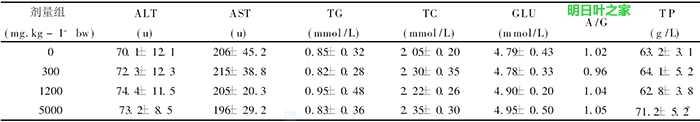
表2 明日叶茶对大鼠血清生化指标的影响( x-± s)
2.3.3 病理学检查
大鼠各剂量组主要脏器系数(肝、肾、胸腺、心、脾脏)与溶剂对照组比较差异均无显著性(P>0.05)。在对肝、肾、肺、胃、肠、脾脏和腺的组织病理学检查中,各剂量组脏器均未见异常改变。
2.4 传统致畸试验
各剂量组孕母鼠平均体重和平均增重与阴性组比较差异均无显著性(P>0.05);各剂量组的平均晚死胎数、平均活胎数和平均体重、平均身长以及外观、内脏及骨髓畸形率与阴性组比较差异无显著性(P>0.05),见表3。
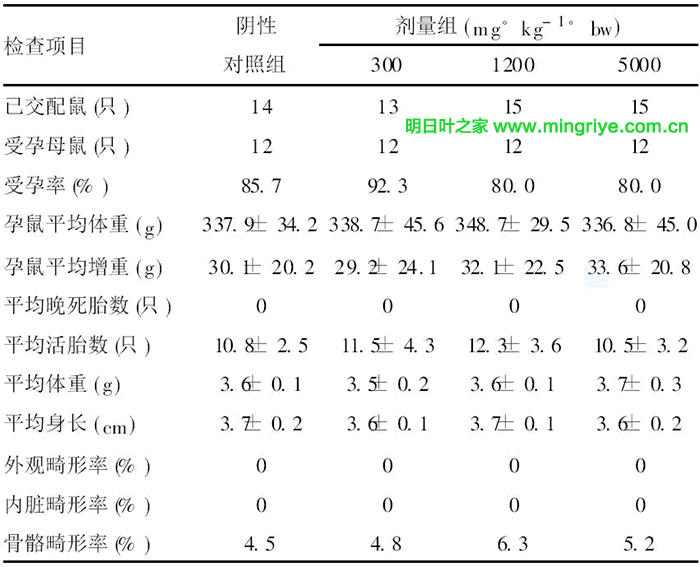
表3 明日叶茶对母鼠胎仔生长发育的影响( x-± s)
3 讨论
按照《食品安全性毒性学评价程序和方法》的要求,我们对明日叶保健茶的毒性进行了第一、二阶段的检测和研实际无毒级;Ames试验、微核试验、小鼠精子畸形试验及骨髓细胞染色体畸变试验等试验结果均为阴性,据此可以认为其潜在的遗传毒性作用较小,在30d喂养试验中,未见引起大鼠的整体健康状况、生理生化功能和器官组织形态学各重要指标的异常变化;在传统致畸试验中未见发育毒性和致畸性。综上所述,可以认为“明日叶保健茶”在推荐剂量3g/(d•人)下,食用是安全的。为了人群的健康,笔者认为,可在保健功能法》[2]的检测及流行病学调查的基础上早日进行研制和开发。
[参考文献]
[1]中华人民共和国卫生部.中华人民共和国国家标准GB15193-94[S].食品安全性毒理学评价程序和方法[A],1994.
[2]严卫星.《保健食品功能评价程序和检验方法》的有关技术问题[J].中国食品卫生杂志,1999,11(2):17-21.
*AD:购买明日叶茶、明日叶粉,十年品牌,品质护航,添加微信:156440577








